화학평형 (4) - 반응 진척도와 반응식을 이용한 해석 본문

화학평형 (3)에서 반응 진척도에 대해 알아보았습니다.
여태까지 익힌 식을 통해 화학반응식의 예시를 들어 이 진척도의 해석을 살펴보도록 하겠습니다.
\(N_2O_4 -> 2NO_2\) 의 반응식으로 살펴보도록 하겠습니다.

진척도에 의해 몰수가 변화하기 때문에
초기 몰 수 1,0 에서 반응을 하면 각각 1-\(\xi\) , 2\(\xi\) 가 됩니다.
이때 전체 몰수가 1-\(\xi\) + 2\(\xi\) 이고
결과적으로 몰 수 \(\frac{1-\xi}{1+\xi}\), \(\frac{2\xi}{1+\xi}\)를 얻게 됩니다.
이때 평형상수 K = \(\frac{(X_{NO_2})^2}{X_{N_2O_4}}\) 이 됩니다. - 분압법칙을 적용해 몰분율을 적용한 값 입니다.
이것이 바로 지금까지 알아봤던 활동도의 곱을 적용한 예시입니다.
따라서 K = \(\frac{(\frac{2\xi}{1+\xi})^2(\frac{p}{p_0})}{\frac{1-\xi}{1+\xi}}\) 이 됩니다.
또 다른 예시를 들어보도록 하겠습니다.
\(N_2\) + 3\(H_2\) -> 2\(NH_3\) 을 생각해보면
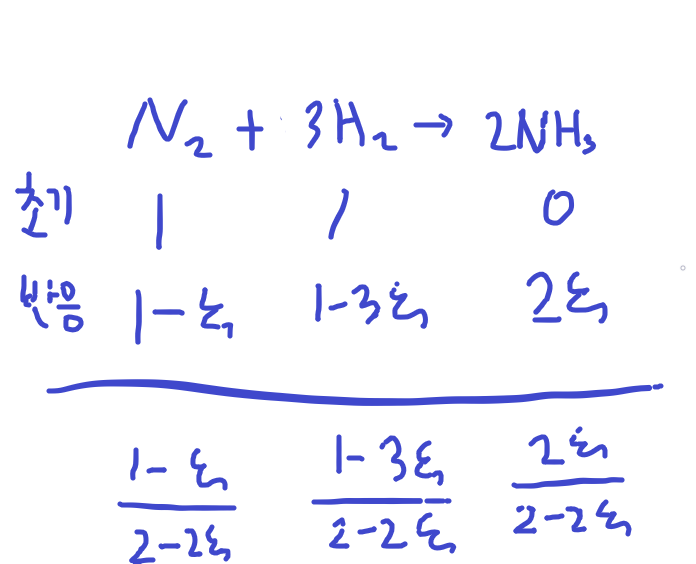
이러한 과정을 보입니다.
이떄 초기 질소와 수소가 동일양이 있다고 가정했을 경우 입니다.
따라서 K = \(\frac{(\frac{2\xi}{2-2\xi})^2}{(\frac{1-\xi}{2-2\xi})(\frac{1-3\xi}{2-2\xi})^3(\frac{p}{p_0})^2}\)
임을 알 수 있습니다.

'과학' 카테고리의 다른 글
| Clapeyron 식과 Clausis-clapeyron 식 /클라우지우스-클라페롱 (1) | 2019.06.11 |
|---|---|
| 상태도 (1) - 상태도의 해석 - 용해한도,상평형, (0) | 2019.06.05 |
| 화학 평형 (3) - 반응 깁스 에너지 / 반응 진척도 / 반응지수/ 활동도/ 반응의 평형상수 (0) | 2019.05.23 |
| 화학평형 (2) - 화학반응식에서 깁스에너지? / 평형상수 (0) | 2019.05.22 |
| 화학평형 (1) - 화학퍼텐셜 (0) | 2019.05.20 |
